Gruppenleitung

Univ.-Prof. Dr.rer.nat. Sebastian Preissl
Herz-Kreislauf-Erkrankungen
Herz-Kreislauf-Erkrankungen, einschließlich Herzinsuffizienz und Vorhofflimmern, sind weltweit eine der häufigsten Ursachen für Morbidität und Mortalität. Ziel unserer Forschung ist es, transkriptionelle und epigenetische Faktoren, molekulare Signalwege sowie regulatorische Elemente, z. B. Enhancer, als mögliche Angriffspunkte zur Therapie von Herz-Kreislauf-Erkrankungen zu identifizieren und zu charakterisieren.
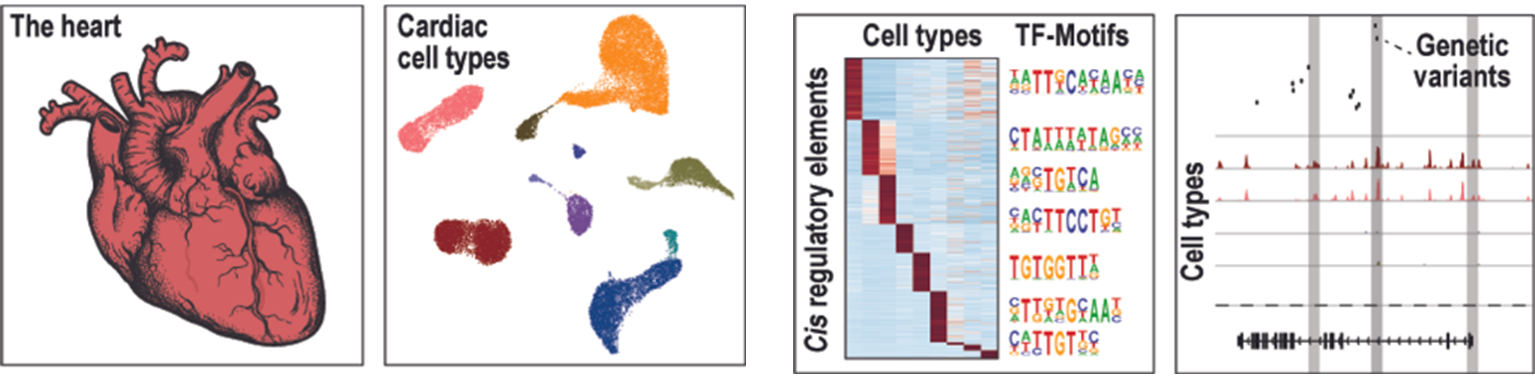
Wir verwenden eine Kombination aus epigenomischen/multiomischen Einzelzelltechnologien, Mausmodellen und Ansätze der funktionellen Genomik in Zellkulturmodellen, um (1) die zelltypspezifische Genregulation in kardialen Zelltypen aufzudecken, (2) die Kommunikation zwischen verschiedenen Herzzelltypen zu untersuchen, (3) die molekulare Funktion von genetischen Varianten aufzudecken, die mit Herz-Kreislauf-Erkrankungen in Verbindung stehen.
Wir hoffen, dass unsere Forschung dazu beitragen kann, neue Strategien für Herz-Kreislauf-Erkrankungen zu entwickeln.
Ein Teil dieses Projektes ist ein Teilprojekt des DFG-geförderten GRK 2344: MeInBio – BioInMe und unterstützt durch den DFG-geförderten SFB1425: Heterocellular Nature of Cardiac Lesions: Identities, Interactions, Implications.
Autosomal-dominante polyzystische Nierenerkrankung
Die autosomal-dominante polyzystische Nierenerkrankung (ADPKD) ist die häufigste genetische Ursache für Nierenversagen, von der über 12 Millionen Menschen betroffen sind. Mutationen in PKD1 und PKD2 führen zur Zystenbildung in einzelnen Nierenepithelzellen, was zelluläre Umbauprozesse und Immunzellinfiltration zur Folge hat. Das Ziel dieses Projektes ist es genregulatorischen Programme zu identifizieren, die diesen Umbauprozessen zugrundeliegen. Wir untersuchen die Krankheitsinitiierung und -progression zu definierten Zeitpunkten im Mausmodell und analysieren sowohl zelltypspezifische Genregulationsprogramme als auch zelluläre Interaktionen während der Zystenentstehung und der Krankheitsprogression aufzudecken.
Dieses Projekt ist ein Teilprojekt im DFG-geförderten SFB1453: Nephrogenetik (NephGen) gemeinsam mit Prof. Dr. Michael Köttgen (Universität Freiburg, Deutschland).
Perinatale Entwicklung der dermalen Makrophagen-Diversität
Gewebemakrophagen (Mφ) sind der häufigste Immunzelltyp in der Haut. Ihre vielfältigen Aufgaben reichen von der Abwehr von Krankheitserregern bis zur Gewebereparatur. Das Projekt beschäftigt sich vor allem mit Faktoren, die während der perinatalen Entwicklung die dermale Macrophagen (Mφ)-Diversität beeinflussen. Dermale Mφ unterscheiden sich in Ursprung, Genexpressionsprofilen und Lokalisierung. Die Anpassung der Mφ hängt von einem komplexen Zusammenspiel molekularer Faktoren ab, zu denen auch epigenetische Prozesse gehören. Ziele des Projektes sind ein umfassendes Verständnis (1) der dermalen Mφ-Subtypen und ihrer Gewebenischen, (2) der der Mφ-Anpassung zugrundeliegenden genregulatorischen Programme und (3) den Einfluss der Mφ-Subtypen auf die Etablierung der dermalen Immunität zu erhalten.
Dieses Projekt ist ein Teilprojekt im DFG-geförderten TRR359: Perinatale Entwicklung der Immunzell-Topologie (PILOT) gemeinsam mit Dr. Julia Kolter (Universität Freiburg, Deutschland).
Methoden
Single Cell Genomics (Single cell ATAC-seq, single cell/nucleus RNA-seq, single cell/nucleus Multiomics)
Spatial Transcriptomics (MERFISH)
Epigenomics (ATAC-seq, ChIP-seq, CUT&Tag/RUN)
Functional Genomics (CRISPR perturbation)
Zellkulturmodelle und Mausmodelle