O.Univ.-Prof. Dr.phil. Bernhard-Michael Mayer
Telefon:+43 316 380 - 5567
Ort:Institut für Pharmazeutische Wissenschaften
Forschungsschwerpunkte
Vaskuläre NO/cGMP-Signalgebung
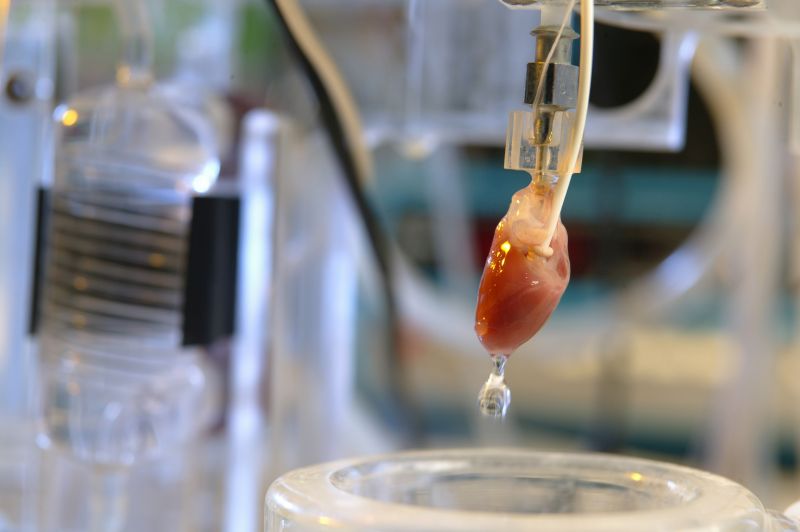
Verschiedene physiologische Funktionen wie die Entspannung der glatten Muskelzellen und die Thrombozytenaggregation werden durch die Botenstoffe Stickstoffmonoxid (NO) und zyklisches Guanosinmonophosphat (cGMP) reguliert. Um die molekularen Mechanismen zu untersuchen, die an der NO/cGMP-Signalübertragung und ihrer Regulierung unter physiologischen und pathophysiologischen Bedingungen beteiligt sind, verwenden wir Ex-vivo-Gewebe-Modelle (z. B., (z.B. vasomotorische Funktionsstudien in Organbädern, Langendorff-Perfusion isolierter Herzen), Zellkulturmodelle (z.B. Endothelzellen, glatte Muskelzellen) sowie enzymatische Assays mit gereinigten Enzymen einschließlich NO-Synthase (NOS), löslicher Guanylylcyclase (sGC) und Aldehyddehydrogenase II (Aldh2). Die Ergebnisse der Forschung sollen zu einem besseren Verständnis der Rolle von NO/cGMP als Regulator des Blutdrucks und der Herzfunktion bei Gesundheit und Krankheit beitragen. In einem erweiterten Ansatz wird die NO/cGMP-Signalübertragung in Blutgefäßen und im Herzen untersucht, wobei ein besonderer Schwerpunkt auf der Lipid- und Kohlenhydrathomöostase liegt.


Kardiale Adenosin-Signalgebung
Ein weiteres Forschungsinteresse gilt der Untersuchung der schützenden Wirkung von Adenosin-Signalen im Herzen. Besonderes Augenmerk wird dabei auf die Rolle der Adenosinkinase (ADK) gelegt, die die Umwandlung von Adenosin in Adenosinmonophosphat (AMP) katalysiert. Die Modulation des kardialen Adenosinspiegels wird durch pharmakologische Hemmung oder genetische Manipulationen bei Mäusen erreicht. Die Studien werden mit isolierten Kardiomyozyten und Mausmodellen durchgeführt. In diesem Zusammenhang ist die Verbindung zwischen dem Adenosin-Stoffwechsel und der kardialen Protein-Qualitätskontrolle von besonderem Interesse.

Perivaskuläres Fettgewebe
Heutzutage wird das Fettgewebe nicht mehr als passiver Speicher für überschüssige Energie betrachtet, sondern als hochaktives endokrines Organ, das vasoaktive Hormone und entzündliche Zytokine abgibt. Ein Forschungsschwerpunkt ist es, die Rolle des Fettgewebes bei der Entstehung von Herz-Kreislauf-Erkrankungen zu entschlüsseln. Besonderes Augenmerk wird auf die Entzündung des perivaskulären Fettgewebes gelegt. Zu diesem Zweck werden Studien mit kultivierten Fettzellen, isolierten Geweben und transgenen Mausmodellen durchgeführt. Diese Studien sollen einen tieferen Einblick in die Fett-Gefäß-Achse geben und könnten den Weg für die Entwicklung neuer therapeutischer Strategien für stoffwechselbedingte Herz-Kreislauf-Erkrankungen ebnen.
Blutplättchen und Immunzellen
Neben ihrer zentralen Rolle bei der Blutstillung modulieren Thrombozyten Immunreaktionen durch direkte Interaktion mit Immunzellen wie Monozyten und Neutrophilen sowie durch die Freisetzung ihres Granulatgehalts, der eine Fülle von Molekülen wie Wachstumsfaktoren und Entzündungsmoleküle enthält. Thrombozyten sind empfindliche Wächter, die als Reaktion auf metabolische/entzündliche Stimuli aktiviert werden und zur Entwicklung von Atherosklerose, Fettlebererkrankungen und Fettgewebeentzündungen beitragen. Das Verständnis der Mechanismen der Thrombozytenaktivierung und der Thrombozyten-vermittelten Immunreaktionen unter pathologischen Bedingungen wird dazu beitragen, das therapeutische Potenzial der Thrombozyten zu nutzen.
Diabetes
Das Fettgewebe ist mehr als nur ein wichtiges Organ zur Energiespeicherung. Es spielt eine zentrale Rolle bei der Aufrechterhaltung der metabolischen Homöostase und fungiert als endokrines Organ. Dysfunktionales Fettgewebe steht in engem Zusammenhang mit Stoffwechselanomalien wie Dyslipidämie, Insulinresistenz und Glukoseintoleranz. Die Kombination dieser Anomalien, die als metabolisches Syndrom bekannt ist, trägt wesentlich zur Morbidität/Mortalität bei einer Vielzahl von Krankheiten bei, darunter auch Typ-2-Diabetes. Typ-2-Diabetes wird hauptsächlich durch Fettablagerungen in insulinempfindlichen Geweben (z. B. Leber, Skelettmuskel) und insulinsezernierenden Betazellen verursacht. Eine Modifizierung der aus dem Fettgewebe stammenden Lipidmetaboliten birgt daher therapeutisches Potenzial, indem sie die ektopische Lipidakkumulation reduziert und damit die periphere Insulinwirkung verbessert, aber auch indem sie direkt signalgebende Lipide für die Betazellfunktion bereitstellt. Ein Schwerpunkt unserer Forschung ist die Untersuchung der Mechanismen, durch die aus dem Fettgewebe stammende Lipide zur Insulinsekretionsfunktion der Bauchspeicheldrüse beitragen, um neue Erkenntnisse über die Pathophysiologie des Diabetes zu gewinnen.

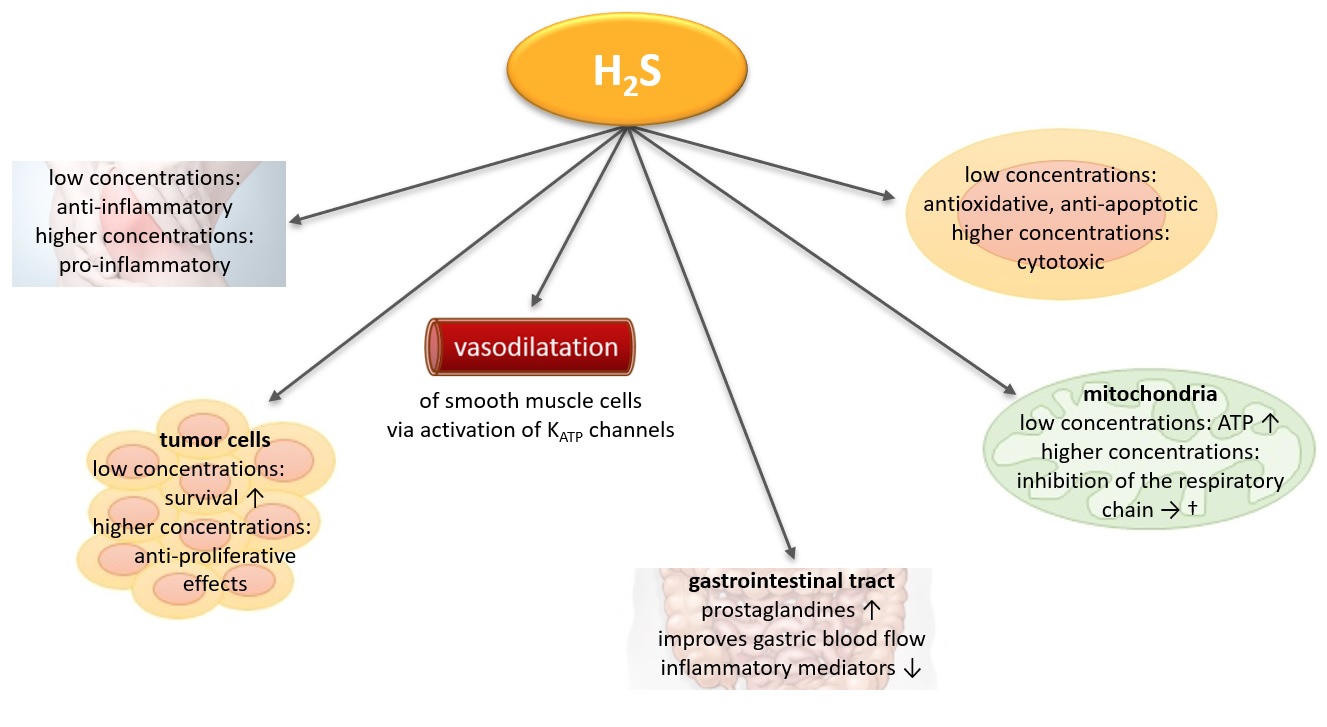
H2S
Die Forschungsprogramme des Ludwig Boltzmann Instituts für Arthritis und Rehabilitation (LBIAR) befassen sich mit Fragen der klinischen und translationalen Forschung in den Bereichen Rheumatologie, Balneologie und Rehabilitation. Der Schwerpunkt der klinischen Forschung liegt auf den beiden wichtigsten rheumatischen Erkrankungen, der rheumatoiden Arthritis (RA) und der Osteoarthritis (OA), der Schwerpunkt der translationalen Forschung auf den zellulären und molekularen Mechanismen der Balneotherapie, insbesondere der Schwefelkur, der Radon- und Kernspinresonanztherapie. Das Hauptziel der in der Abteilung für Pharmakologie und Toxikologie angesiedelten Forschungsgruppe besteht darin, die zugrunde liegenden zellulären und molekularen Mechanismen von H2S in vitro und in vivo aufzuklären. Daher werden die folgenden Fragen untersucht:
- Welche Zelltypen reagieren auf die Behandlung mit exogenem H2S?
- Welches sind die primären Auswirkungen bei entzündlichen und degenerativen Prozessen?
- Welche molekularen Mechanismen liegen der H2S-Signalübertragung zugrunde?
- Entwicklung neuartiger H2S freisetzender Medikamente für eine mögliche therapeutische Anwendung.