Gruppenleitung
Priv.-Doz. Mag.pharm. Dr.rer.nat. Alexander Kollau
Vaskuläre NO/cGMP-Signalgebung
Verschiedene physiologische Funktionen wie die Entspannung der glatten Muskelzellen und die Thrombozytenaggregation werden durch den gasförmigen Botenstoff Stickstoffmonoxid (NO) und zyklisches Guanosinmonophosphat (cGMP) reguliert. Um die molekularen Mechanismen zu untersuchen, die an der NO/cGMP-Signalübertragung und ihrer Regulierung unter physiologischen und pathophysiologischen Bedingungen beteiligt sind, verwenden wir Ex vivo Gewebemodelle (z.B. vasomotorische Funktionsstudien in Organbädern, Langendorff-Perfusion isolierter Herzen), 2D- und 3D-Zellkulturmodelle (z.B. Endothelzellen, glatte Muskelzellen) sowie enzymatische Assays mit gereinigten Enzymen einschließlich NO-Synthase (NOS), löslicher Guanylylcyclase (sGC). Die Ergebnisse der Forschung sollen zu einem vertieften Verständnis der Rolle von NO/cGMP als Regulator des Blutdrucks und der Herzfunktion bei Gesundheit und Krankheit beitragen. In einem erweiterten Ansatz wird die NO/cGMP-Signalübertragung in Blutgefäßen und im Herzen unter besonderer Berücksichtigung der Lipid- und Kohlenhydrathomöostase untersucht.
Epitheliale Barriere der Atemwege
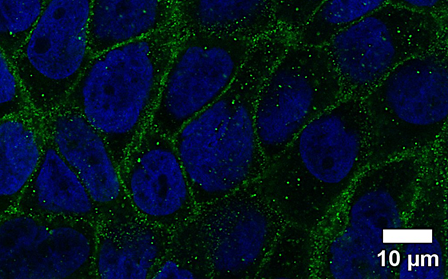
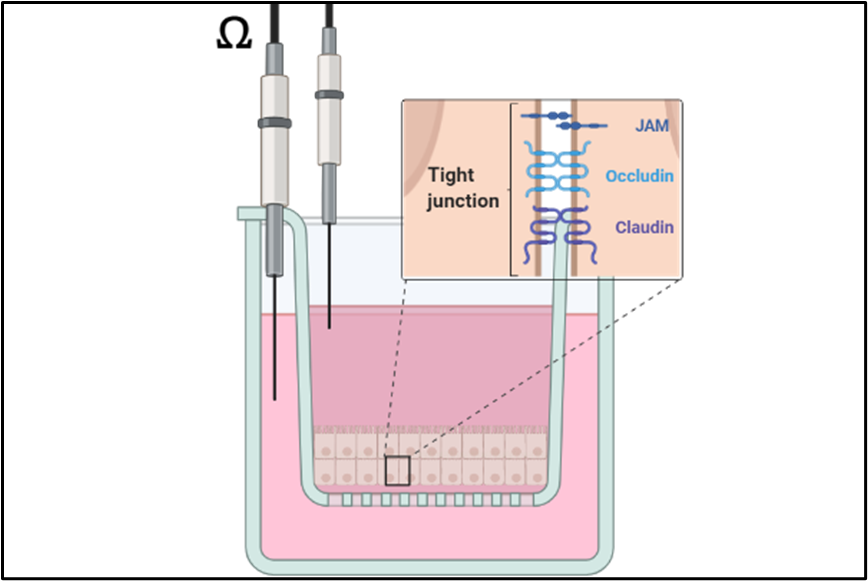
Die Lunge ist im Zuge der Ventilation ständig verschiedensten Umweltfaktoren ausgesetzt. Um den Organismus vor Noxen und pathogenen Mikroorganismen zu schützen, ist eine intakte Barriere des Bronchialepithels erforderlich. Da diese Barriere durch Einflüsse (z.B. Tabakrauch, Feinstaub, Reizgase) geschädigt wird, konzentriert sich unsere Forschung auf die Charakterisierung der Mechanismen diverser Inhalationsnoxen sowie die Entwicklung protektiver Gegenmaßnahmen (Kooperation mit dem Bereich Pharmakognosie). Dazu werden Mono- und Co-Kulturen von humanen Lungenepithelzellen mit Gefäßendothelzellen auf Transwell-Inserts angelegt, um als Modell für ein Liquid-Liquid- bzw. Air-Liquid-Interface zu dienen. Gasförmige Stoffe können so direkt oder als wässrige Zubereitung unter normoxischen und hypoxischen Bedingungen getestet werden. Die Integrität der Barriere wird über Funktionsassays (transepithelialer elektrischer Widerstand, Permeabilitätsassay) gemessen sowie biochemisch (Westernblot, RT-qPCR) und durch Immunfluoreszenzmikroskopie charakterisiert.